Verdens første galvaniske celle blev udviklet af Luigi Galvani. Læs om dens historie. i denne artikelDet er i bund og grund en midlertidig kilde til elektrisk strøm, der genereres af en kemisk reaktion. Strømmen af elektroner genereres af interaktionen mellem to forskellige metaller. Som et resultat omdannes kemisk energi til elektrisk energi, som derefter kan bruges i hverdagen.
En koncentrationsgalvanisk celle er en strømkilde, der består af to identiske metalelektroder placeret i en blanding af salte af dette metal i forskellige koncentrationer.
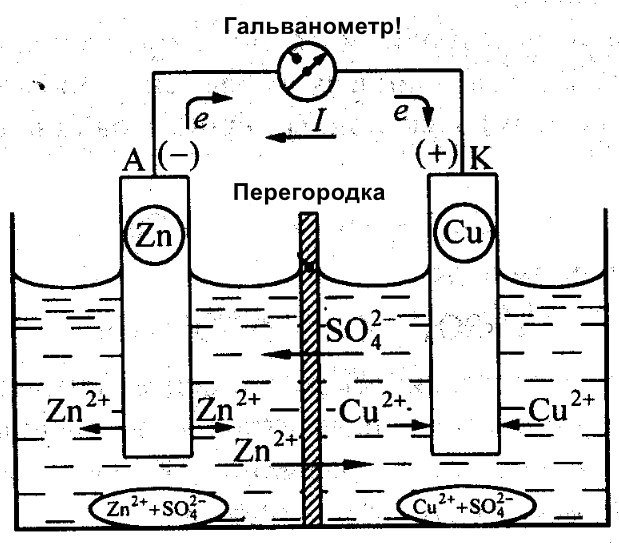
Udover Galvani arbejdede Daniel Jacobi også på at skabe et effektivt batteri. Han modificerede sin energikilde en smule. Den består af en kobberplade placeret i CuSO4 og en zinkplade nedsænket i ZnSO4. For at forhindre dem i at interagere direkte, er der placeret en porøs væg mellem dem. Nedenfor er et diagram over Daniel Jacobis galvaniske celle.
Zink og kobber har forskellig reaktivitet, og derfor vil deres ladning variere. Som følge heraf er elektrodernes niveauer heller ikke ensartede. Dette gør det muligt for dem at bevæge sig og generere en elektrisk eller galvanisk strøm. Denne strøm begynder at flyde, når en person eller opfinderen af en strømlagringsenhed tilslutter en belastning. Denne belastning kan være en pære, en radio, en computermus eller andre elektriske apparater.
Skematisk diagram over en galvanisk celle
Et kredsløbsdiagram refererer til dets sammensætning og struktur. Det kan konstrueres af flere kemiske elementer ved hjælp af hjælpeenheder. Nedenfor vil strukturen af en galvanisk celle kort blive beskrevet. Læs mere om det i denne artikel.!
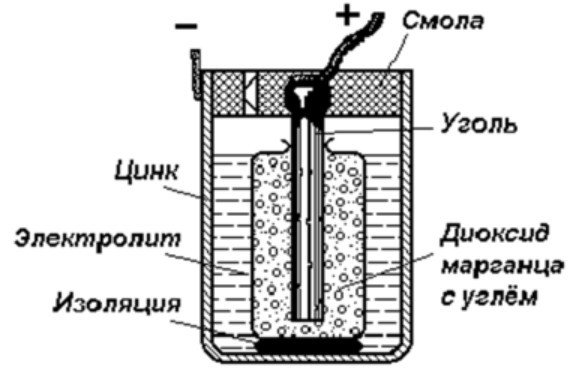
Strukturen af en galvanisk celle
Den enkleste energilagringsenhed består af:
- Stang af kul.
- To forskellige metaller.
- Elektrolyt.
- Harpiks eller plastik.
- Isolator.
Som det fremgår af dette diagram, består en galvanisk celle af en negativ og en positiv elektrode. De kan være lavet af kobber, zink eller andre metaller. De kaldes kobber-zinkceller. De kaldes undertiden tørbatterier.
Betegnelse af en galvanisk celle i et diagram Den er lavet i form af to lodrette linjer, tæt på hinanden med lille afstand. En af dem vil være mindre. Ved kanterne af hver sådan linje er der skilte, der angiver polaritetDen lange linje er markeret positiv, og den korte linje negativ. Spændingen kan vises ved siden af. Det betyder, at kredsløbet, der bruger batteriet, kun fungerer ved den spænding.
Funktionsprincippet for en galvanisk celle
En galvanisk celle fungerer ved at elektroner bevæger sig fra en metalkontakt til en anden. Der sker en kemisk transformation. Læs mere om termodynamikken i en galvanisk celle og dannelsen af galvanisk elektricitet. Her.
Svar på ofte stillede spørgsmål
| Galvanisk | Forklaring |
| Batteri | En energikilde, der fungerer gennem processer, der finder sted inden for et begrænset, miniature rum. Mere specifikt genereres energi gennem en kemisk reaktion. |
| Voltaisk celle eller voltaisk bunke | Dette er et energielement, der først blev skabt af en videnskabsmand ved navn Volt. |
| Behandle | Vekselvirkningen mellem kemiske elementer, der resulterer i dannelsen af en elektrisk strøm. |
| Udledning | Dette er fuldførelsen af en kemisk reaktion. Det vil sige, at der ikke vil være nogen interaktion mellem stofferne. Galvanisk udladning findes i Warframe. Det er i bund og grund en modifikation, der er mangelvare. Den bruges til nærkampsvåben. PolaritetV2. |
| Galvanisk kontakt | Dette er kontakten mellem elektroderne og opløsningen. |
| Effekt | Forskellen mellem to kontakter lavet af to typer metal. Størrelsen afhænger af ledernes temperatur og kemi. Dette er i bund og grund Voltas første lov. |
| Forbindelse/led/kæde | Tilslutning af to eller flere sektioner af et elektrisk kredsløb til en strømkilde. |
| Galvanisk ladning | Fyldning af batteriet med energi. |
Galvanisering er en kemisk proces, der bruger elektrisk strøm. Reaktionen reducerer mængden af opløste metalkationer i en sådan grad, at de til sidst danner en ensartet belægning på en metalelektrode. Som følge heraf bliver emnet mere holdbart, små buler forsvinder, og dets udseende bliver mere attraktivt.
Typer af galvaniske celler
Der findes en række specifikke typer batterier.
Tabel over galvaniske celler
| Type | Spænding | De vigtigste fordele |
| Litium | 3 V | Stor kapacitet, høj strøm. |
| Saltbatterier eller kulstof-zink | 1,5 tommer | Den billigste. |
| Nikkeloxyhydroxyl NiOOH | 1,6 volt | Høj strøm. Høj kapacitet. |
| Alkalisk eller alkalisk | 1,6 V | Høj strøm. God lydstyrke. |
Dette emne er dækket mere detaljeret i artiklen. typer af batterier!
Formålet med en galvanisk celle
Den er designet til at starte elektrisk udstyr. Disse kan omfatte:
- Ur.
- Fjernbetjeninger.
- Lommelygter.
- Medicinsk udstyr.
- Bærbare computere.
- Legetøj.
- Nøgleringe.
- Telefoner.
- Laserpointere.
- Lommeregnere.
Og lignende ting omkring os.
Galvanisk celle derhjemme
Du kan selv lave en simpel strømkilde. For at gøre dette skal du bruge følgende materialer:
- Plastikkop.
- Elektrolyt. Dette kan være en saltvandsopløsning, sodavand eller citronsyre fortyndet i vand.
- Plader af to forskellige metaller. For eksempel aluminium og kobber.
- Ledninger
Fremstillingsproces
Tag en plastikkop og hæld elektrolytten i den. Fyld den ikke helt op til randen; det er bedst at lade den være 1-2 centimeter kort. Fastgør ledningerne til metalpladerne. Placer derefter kobber- og aluminiumspladerne på beholderens kanter. De skal være parallelle med hinanden. Når alt er klar, kan du måle spændingen med et voltmeter.
Tilslut enheden, og berør proberne til kontakterne på vores strømkilde. Hold dem på plads, indtil displayet viser spænding. Typisk er det 0,5-0,7 volt. Disse værdier afhænger af elektrolytten, eller mere præcist, det stof, der bruges som elektrolyt.
Sådan laves en hjemmelavet galvanisk celle.